Resumen
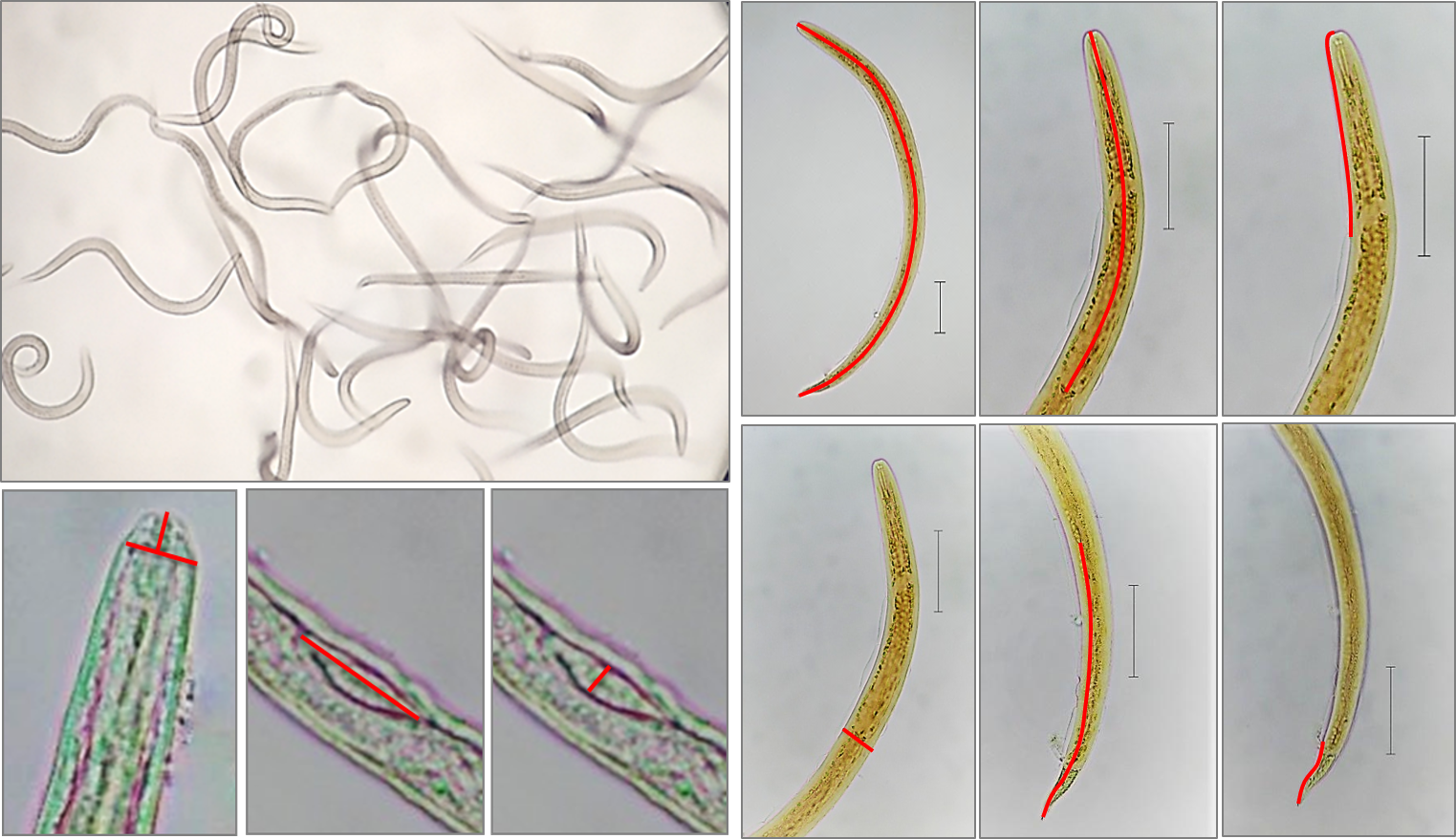
La identificación de nematodos de interés médico y veterinario en muestras de suelo o alimentos es una acción compleja, debido a la gran diversidad de nematodos en el medio. El objetivo del estudio fue realizar la caracterización morfológica y morfométrica de diferentes estadios larvarios de Strongyloides stercoralis, Strongyloides venezuelensis, anquilostomas, Angiostrongylus cantonensis y Angiostrongylus costaricensis, con el fin de orientar el diagnóstico diferencial con otras especies de nematodos ambientales. Para realizar el estudio se fijaron las larvas y se midieron varios parámetros corporales, para lo cual se realizó estadística descriptiva y estudio de similitud entre especies del mismo género. Los resultados de las larvas estándar fueron compatibles con los descritos para la especie, con variabilidad en algunos parámetros. S. stercoralis y S. venezuelensis mostraron similitud de 59% para L1 y 79% para L3, con mayor diferenciación para EA, GPC y LPG. En el pool de larvas de anquilostomiasis hubo una gran variación en los parámetros evaluados, especialmente en relación con el CTC. Las larvas de A. cantonensis y A. costaricensis mostraron 48% de similitud entre L1 y 76% para L3. Mediante análisis morfométrico y de similitud se verificó la posibilidad de mejorar el diagnóstico diferencial de nematodos de origen ambiental.
Citas
1. De Ley P. A quick tour of nematode diversity and the backbone of nematode phylogeny [Internet]. WormBook: The Online Review of C. elegans Biology. WormBook; 2006. [acesso 2020 Fev 09]. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK19684/
2. Ferraz LCCB, Brown DJF, editores. Nematologia de plantas: fundamentos e importância. Manaus: Norma Editora; 2016. p. 251. [acesso 2020 Jul 27]. Disponível em: https://www.nematologia.com.br/files/livros/1.pdf
3. Blaxter M. Nematodes: the worm and its relatives. PLoS Biology. 2011;9(4):e1001050. https://doi.org/10.1371/journal.pbio.1001050
4. Ferraz LCCB. Nematoides. In: Manual de fitopatologia: princípios e conceitos. São Paulo: Agronômica Ceres; 2018. p. 1-18. Disponível em: https://www.researchgate.net/publication/324391159
5. Seesao Y, Gay M, Merlin S, Viscogliosi E, Aliouat-Denis CM, Audebert C. A review of methods for nematode identification. J Microbiol Methods. 2017;138:37-49. https://doi.org/10.1016/j.mimet.2016.05.030
6. Bogale M, Baniya A, DiGennaro P. Nematode identification techniques and recent advances. Plants. 2020;9(10):1260. https://doi.org/10.3390/plants9101260
7. Amoah ID, Singh G, Stenström TA, Reddy P. Detection and quantification of soil-transmitted helminths in environmental samples: a review of current state-of-the-art and future perspectives. Acta Trop. 2017;169:187-201. https://doi.org/10.1016/j.actatropica.2017.02.014
8. Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D et al. Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet. 2006;367(9521):1521-32. https://doi.org/10.1016/S0140-6736(06)68653-4
9. Adenusi AA, Abimbola WA, Adewoga TO. Human intestinal helminth contamination in prewashed, fresh vegetables for sale in major markets in Ogun State, southwest Nigeria. Food Control. 2015;50:843-9. https://doi.org/10.1016/j.foodcont.2014.10.033
10. Luz JGG, Barbosa MV, Carvalho AG, Resende SD, Dias JVL, Martins HR. Contamination by intestinal parasites in vegetables marketed in an area of Jequitinhonha Valley, Minas Gerais, Brazil. Rev Nutr. 2017;30(1):127-36. https://doi.org/10.1590/167898652017000100012
11. Silva LGB, Silva LMB, Arrais FMA, Melanda GCS, Ferreira RJ. Prevalência de estruturas parasitárias de protozoários e de helmintos em hortaliças comercializadas em barracas de rua no município de Crato–CE, Brasil. Revista Saúde (Santa Maria). 2018;44(3). https://doi.org/10.5902/2236583429982
12. Rodrigues AC, Silva MDC, Pereira RAS, Pinto LC. Prevalence of contamination by intestinal parasites in vegetables (Lactuca sativa L. and Coriandrum sativum L.) sold in markets in Belém, northern Brazil. J Sci Food Agric. 2020;100:2859-65. https://doi.org/10.1002/jsfa.10265
13. Amer OH, Ras R, El-Alfy SA, Raef A. Prevalence and morphological characters of Strongyloides stercoralis contaminating some fresh raw vegetables in Sharkia province, Egypt. EVMSPJ. 2020;16:158-71. https://doi.org/10.21608/evmspj.2020.132894
14. Waugh CA, Lindo JF, Lorenzo-Morales J, Robinson RD. An epidemiological study of A. cantonensis in Jamaica subsequent to an outbreak of human cases of eosinophilic meningitis in 2000. Parasitology. 2016;143(9):1211-17. https://doi.org/10.1017/S0031182016000640
15. Kramer KJ, Posner J, Gosnell WL. Role of gastropod mucus in the transmission of Angiostrongylus cantonensis, a potentially serious neurological infection. ACS Chem Neurosci. 2018;9(4):629-32. https://doi.org/10.1021/acschemneuro.7b00491
16. Harada YAOM, Mori O. A New Method for culturing Hook Worm. Yonago Acta Med. 1955;1(3):177-9.
17. Rocco SC. Infecção natural de nematódeos parasitas em Achatina fulica Ferussac (Gigante Africano) (gastropoda: Pulmonata: Stylommatophora) relacionada com as condições sanitárias em vida livre e em criações comerciais no Estado de São Paulo. [tese de doutorado]. São Paulo (SP): Secretaria de Estado da Saúde de São Paulo; 2007. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/sus-19498
18. Mota DJG. Infecção natural por larvas de metastrongilídeos em moluscos terrestres de diferentes regiões do estado de São Paulo [tese de doutorado]. São Paulo (SP): Secretaria de Estado da Saúde de São Paulo; 2018. Disponível em: https://docs.bvsalud.org/biblioref/2019/08/1008307/dan-tese-final_.pdf
19. Yamada LFP. Detecção de nematódeos em alfaces (Lactuca sativa L.) comercializadas em São Paulo: diagnóstico diferencial com padrão de larvas de risco à saúde [dissertação de mestrado]. São Paulo (SP): Secretaria de Estado da Saúde de São Paulo; 2021. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1358837
20. Little MD. Comparative morphology of six species of Strongyloides (Nematoda) and redefinition of the genus. J Parasitol. 1966;52(1):69-84. https://doi.org/10.2307/3276396
21. Miné JC. Caracterização de cepas de Strongyloides stercoralis (Bavay, 1876) Stiles & Hassal, 1902 (Rhabditida, Strongyloididae) isoladas de pacientes com e sem sintomatologia da região de Araraquara-SP. [tese de doutorado]. Araraquara (SP): Universidade Estadual Paulista; 2009. Disponível em: https://repositorio.unesp.br/handle/11449/104538
22. Joachim A, Dülmer N, Daugschies A. Differentiation of two Oesophagostomum spp. from pigs, O. dentatum and O. quadrispinulatum, by computer-assisted image analysis of fourth-stage larvae. Parasitol Int. 1999;48(1):63-71. https://doi.org/10.1016/S1383-5769(99)00003-3
23. van Wyk JA, Cabaret J, Michael LM. Morphological identification of nematode larvae of small ruminants and cattle simplified. Vet Parasitol. 2004; 119(4):277-306. https://doi.org/10.1016/j.vetpar.2003.11.012
24. Ash LR. Diagnostic morphology of the third-stage larvae of Angiostrongylus cantonensis, Angiostrongylus vasorum, Aelurostrongylus abstrusus, and Anafilaroides rostratus (Nematoda: Metastrongyloidea). J Parasitol. 1970; 56(2):249-53. https://doi.org/10.2307/3277651
25. Mota DJG, Melo LCV, Pereira-Chioccola VL, Gava R, Pinto PLS. First record of natural infection by Angiostrongylus cantonensis (Nematoda: Metastrongyloidea) in Belocaulus willibaldoi and Rattus norvegicus in an urban area of São Paulo city, SP, Brazil. Heliyon. 2020;6(10):e05150. https://doi.org/10.1016/j.heliyon.2020.e05150
26. Teixeira ATLS. Strongyloides stercoralis: frequência em exames parasitológicos do Hospital de Clínicas da UNICAMP e análise morfométrica das larvas. Rev Soc Bras Med Trop. 1997;30(1):75-6. https://doi.org/10.1590/S0037-86821997000100016
27. Tobar J, Sarmiento DR, Tayupanta D, Rodríguez M, Aguilar F. Microscopic and molecular evaluation of Strongyloides venezuelensis in an experimental life cycle using Wistar rats. Biomédica. 2021;41(Supl. 1):35-46. https://doi.org/10.7705/biomedica.5650
28. Vieira FM, Lima SS, Bessa ECA. Morfologia e biometria de ovos e larvas de Strongyloides sp. Grassi, 1879 (Rhabditoidea: Strongyloididae), parasito gastrointestinal de Hydrochaeris hydrochaeris (Linnaeus, 1766) (Rodentia: Hydrochaeridae), no Município de Juiz de Fora, Minas Gerais. Rev Bras Parasitol Vet. 2006;15(1):7-12. Disponível em: https://www.redalyc.org/pdf/3978/397841457002.pdf
29 Nichols RL. The etiology of visceral larva migrans: II. Comparative larval morphology of Ascaris lumbricoides, Necator americanus, Strongyloides stercoralis and Ancylostoma caninum. J Parasitol. 1956;42(4):363-99. https://doi.org/10.2307/3274519
30. Burrows RB. Comparative morphology of Ancylostoma tubaeforme (Zeder, 1800) and Ancylostoma caninum (Ercolani, 1859). J Parasitol. 1962;48(5):715-18. https://doi.org/10.2307/3275261
31. Yoshida Y. Comparative Studies on Ancylostoma braziliense and Ancylostoma ceylanicum. II. The infective larval stage. J Parasitol. 1971;57(5):990-2. https://doi.org/10.2307/3277852
32. Corrêa LL, Silva MIPG, Silva RM, Dias RMDS. Ancylostoma duodenale e Necator americanus: diagnóstico diferencial das larvas infestantes e prevalência em amostras fecais provenientes da grande São Paulo. Rev Inst Adolfo Lutz. 1979;39(2):145-53. Disponível em: https://periodicos.saude.sp.gov.br/index.php/RIAL/article/view/37309
33. Babu KN, Rajesh MK, Samsudeen K, Minoo D, Suraby EJ, Anupama K et al. Randomly amplified polymorphic DNA (RAPD) and derived techniques. Methods Mol Biol. 2014;1115:191-209. https://doi.org/10.1007/978-1-62703-767-9_10
34. Gzyl A, Augustynowicz E. Technical aspects of random amplified polymorphic DNA (RAPD) technique in genotyping of bacterial strains. Acta Microbiol Pol. 1999;48(3):243-59. Disponível em: https://pubmed.ncbi.nlm.nih.gov/10756711
35. Howard J, Carlton JMR, Walliker D, Jensen JB. Use of random amplified polymorphic DNA (RAPD) technique in inheritance studies of Plasmodium falciparum. J Parasitol. 1996;82(6):941-6. https://doi.org/10.2307/3284203
36. Ezzat SM, El Sayed AM, Salama MM. Use of random amplified polymorphic DNA (RAPD) technique to study the genetic diversity of eight aloe species. Planta Med. 2016;82(15):1381-6. https://doi.org/10.1055/s-0042-108208
37. Fraga J, Rodriguez J, Fuentes O, Fernandez-Calienes A, Castex M. Optimization of random amplified polymorphic DNA techniques for use in genetic studies of cuban triatominae. Rev Inst Med Trop São Paulo. 2005;47(5):295-300. https://doi.org/10.1590/S0036-46652005000500010
38. Souza F, Santos MA, Alves DA, Melo LCVM, Mota DJG, Pertile AC et al. Angiostrongylus cantonensis in urban populations of terrestrial gastropods and rats in an impoverished region of Brazil. Parasitology. 2021;148(8):994-1002. https://doi.org/10.1017/S0031182021000597

Esta obra está bajo una licencia internacional Creative Commons Atribución 4.0.
Derechos de autor 2023 Revista del Instituto Adolfo Lutz