Resumo
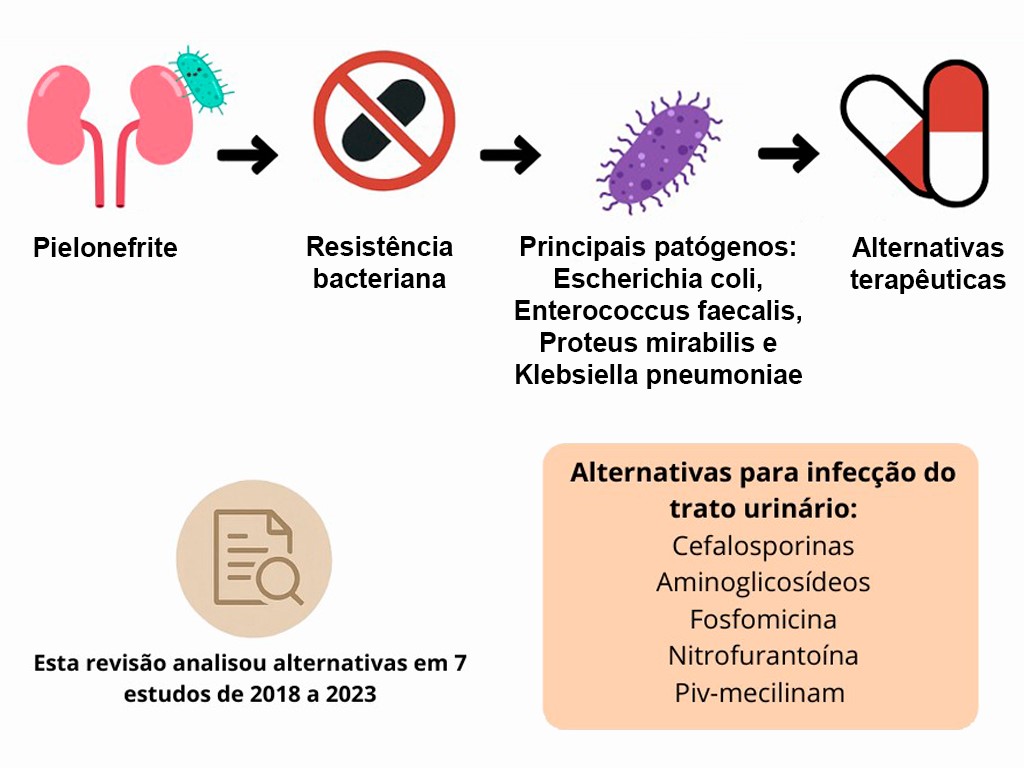
A pielonefrite é uma infecção renal potencialmente grave, geralmente causada por bacilos Gram negativos, como Escherichia coli, Enterococcus faecalis, Proteus mirabilis e Klebsiella pneumoniae. A crescente resistência bacteriana compromete a eficácia dos antibióticos convencionais, dificultando o tratamento e aumentando as recorrências. Este trabalho, por meio de revisão narrativa baseada em sete artigos selecionados nas bases PubMed e BVS (2018-2023), investigou alternativas terapêuticas frente à resistência antimicrobiana em casos de pielonefrite. Os estudos analisados destacaram o uso de cefalosporinas, aminoglicosídeos, fosfomicina, nitrofurantoína e piv-mecilinam como opções viáveis, especialmente em pacientes com resistência a agentes de primeira linha, como fluoroquinolonas e TMP-SMX. Resultados clínicos mostraram eficácia semelhante entre cefalosporinas e antibióticos de primeira escolha, com menor taxa de falha terapêutica associada às primeiras. Em populações específicas, como gestantes e crianças, a fosfomicina e o piv-mecilinam mostraram-se seguros e eficazes, embora exijam monitoramento rigoroso. Conclui-se que o manejo da pielonefrite requer atenção ao perfil de resistência bacteriana, à condição clínica do paciente e à incorporação de terapias alternativas baseadas em evidências. Estratégias personalizadas e atualização das diretrizes clínicas são essenciais para o sucesso terapêutico e a prevenção de complicações, especialmente em populações vulneráveis.
Referências
1. Marques BT, Carvalho MM, Corrêa GR. Pielonefrite. Acta MSM. 2016;4(1):29-38. Disponível em: https://revista.souzamarques.br/index.php/ACTA_MSM/article/view/116
2. Adamy Junior A, Toni R, Yoshikawa GB, Kamei DJ, Sato TTK, Cioni M. Pielonefrite enfisematosa. Rev Med Paraná. 2015;73(2):81-4. Disponível em: https://cms.amp.org.br/arquivos/artigosrevistasarquivos/artigo-1387-revista-medica-do-parana-73-edicao-02-2015_1689360995.pdf
3. Gomel BM, Bolsi GT, Bremmer FP, Nisihara R. Pielonefrite aguda: susceptibilidade bacteriana em manejo hospitalar. 2019;63(4):384-7. Disponível em: https://oldsite.amrigs.org.br/assets/images/upload/pdf/jornal/1594127599.pdf#page=22
4. Kozyrakis D, Kratiras Z, Soukias G, Chatzistamou SE, Zarkadas A, Perikleous S et al. Clinical outcome and prognostic factors of sepsis, septic shock and prolonged hospitalization, of patients presented with acute obstructive pyelonephritis. J Endourol. 2020;34(4):516-22. https://doi.org/10.1089/end.2019.0801
5. Alós JI. Resistencia bacteriana a los antibióticos: una crisis global. Enferm Infecc Microbiol Clin. 2015;33(10):692-9. https://doi.org/10.1016/j.eimc.2014.10.004
6. Telhig S, Said LB, Zirah S, Fliss I, Rebuffat S. Bacteriocins to thwart bacterial resistance in gramnegative bacteria. Front Microbiol. 2020;11:586433. Disponível em: https://www.frontiersin.org/articles/10.3389/fmicb.2020.586433/full
7. Patini R, Mangino G, Martellacci L, Quaranta G, Masucci L, Gallenzi P. The effect of different antibiotic regimens on bacterial resistance: a systematic review. Antibiotics. 2020;9(1):22. https://doi.org/10.3390/antibiotics9010022
8. Li FF, Zhang PL, Tangadanchu VKR, Li S, Zhou CH. Novel metronidazole-derived three-component hybrids as promising broad-spectrum agents to combat oppressive bacterial resistance. Bioorg Chem. 2022;122:105718. https://doi.org/10.1016/j.bioorg.2022.105718
9. Chatzopoulou M, Reynolds L. The role of antimicrobial restrictions in bacterial resistance control: a systematic literature review. J Hosp Infect. 2020;104(2):125-36. https://doi.org/10.1016/j.jhin.2019.09.011
10. Fosse PE, Brinkman KM, Brink HM, Conner CE, Aden JK, Giancola SE. Comparing outcomes among outpatients treated for pyelonephritis with oral cephalosporins versus first-line agents. Int J Antimicrob Agents. 2022;59(4):106560. https://doi.org/10.1016/j.ijantimicag.2022.106560
11. Goodlet KJ, Benhalima FZ, Nailor MD. A systematic review of single-dose aminoglycoside therapy for urinary tract infection: is it time to resurrect an old strategy? Antimicrob Agents Chemother. 2019;63(1):e02165-18. https://doi.org/10.1128/AAC.02165-18
12. Bossa MAG, Mendez MH. Resistencia bacteriana en urocultivos de una población de embarazadas de control prenatal en Bogotá, junio 2013 – junio 2015. Biociencias. 2018;13(2):95-104. Disponível em: https://dialnet.unirioja.es/descarga/articulo/7063684.pdf
13. Sehested LT, Kamperis K, Winding L, Bjerre CK, Neland M, Hagstrøm S et al. Children with acute pyelonephritis need medical re-evaluation when home-treated with oral antibiotics. Acta Paediatr. 2021;110(9):2627-34. https://doi.org/10.1111/apa.15958
14. Weinstein EJ, Han JH, Lautenbach E, Nachamkin I, Garrigan C, Bilker WB et al. A clinical prediction tool for extended-spectrum cephalosporin resistance in community-onset Enterobacterales urinary tract infection. Open Forum Infect Dis. 2019;6(4):ofz164. https://doi.org/10.1093/ofid/ofz164
15. Martínez PJC, Pantoja EGC, Zayas EO. Infecciones del tracto urinário. Revisión bibliográfica. Cienc Serv Salud. 2018;9(1):20-7. https://doi.org/10.47187/cssn.Vol9.Iss1.23
16. Vogler S, Pavich E. Pyelonephritis treatment in the community emergency department: cephalosporins vs. first-line agents. Am J Emerg Med. 2018;36(11):2054-7. https://doi.org/10.1016/j.ajem.2018.08.016
17. Chong Y, Shimoda S, Shimono N. Current epidemiology, genetic evolution and clinical impact of extended-spectrum β-lactamase-producing Escherichia coli and Klebsiella pneumoniae. Infect Genet Evol. 2018;61:185-8. https://doi.org/10.1016/j.meegid.2018.04.005
18. Casas RL, Ortiz M, Erazo-Bucheli D. Prevalencia de la resistencia a la ampicilina en gestantes con infección urinaria en el Hospital Universitario San José de Popayán (Colombia) 2007-2008. Rev Colomb Obstet Ginecol. 2009;60(4):334-8. https://doi.org/10.18597/rcog.316
19. Salomonsson P, Linstow ML, Knudsen JD, Heiberg I, Mola G, Wenger TR et al. Best oral empirical treatment for pyelonephritis in children: do we need to differentiate between age and gender? Infect Dis. 2016;48(10):721-5. https://doi.org/10.3109/23744235.2016.1168937
20. Alsubaie SS, Barry MA. Current status of long-term antibiotic prophylaxis for urinary tract infections in children: an antibiotic stewardship challenge. Kidney Res Clin Pract. 2019;38(4):4410-54. https://doi.org/10.23876/j.krcp.19.091

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Copyright (c) 2025 Bianca Araújo Fernandes Veras, Igor de Sousa Oliveira, Sávio Benvindo Ferreira