Resumo
Os vegetais frescos são altamente benéficos a saúde, mas podem ser fontes de transmissão de helmintos e protozoários provenientes do solo ou da água de irrigação contaminada, especialmente por esgotos sanitários. A identificação desses organismos é desafiadora, devido à sua diversidade no ambiente e aos diferentes estágios evolutivos. Este estudo avaliou a ocorrência de nematódeos em alface in natura e higienizada, realizando o diagnóstico diferencial com larvas de importância médica previamente definidas como padrões. Os nematódeos foram isolados por lavagem das folhas com solução de glicina 1M, seguida de sedimentação espontânea, e analisados por microscopia, considerando critérios morfológicos e morfométricos para o diagnóstico diferencial em relação às larvas de Strongyloides spp., ancilostomídeos e Angiostrongylus spp. Foram isolados 872 nematódeos, 97% deles provenientes de amostras de alface in natura. Os exemplares identificados foram classificados predominantemente como de vida livre, sem compatibilidade morfológica e morfométrica com as larvas padrão. Embora nematódeos de vida livre não representem um risco direto, sua presença nos vegetais, indica um risco indireto à saúde do consumidor, pela possibilidade de atuarem como veículo de outros patógenos. Dada a similaridade entre os espécimes, ressalta-se a importância de critérios precisos de identificação na vigilância desses alimentos para o diagnóstico adequado.
Referências
1. Osafo R, Balali GI, Amissah-Reynolds PK, Gyapong F, Addy R, Nyarko AA et al. Microbial and parasitic contamination of vegetables in developing countries and their food safety guidelines. J Food Qual. 2022;1:4141914. https://doi.org/10.1155/2022/4141914
2. Li J, Wang Z, Karim MR, Zhang L. Detection of human intestinal protozoan parasites in vegetables and fruits: a review. Parasit Vectors. 2020;13:380. https://doi.org/10.1186/s13071-020-04255-3
3. Henz GP, Suinaga F. Tipos de alface cultivados no Brasil. Comunicado Técnico 75. Brasília (DF): Embrapa Hortaliças; 2009. Disponível em: https://www.infoteca.cnptia.embrapa.br/bitstream/doc/783588/1/cot75.pdf
4. Maldonade IR, Mattos LM, Moretti CL. Manual de boas práticas agrícolas na produção de alface. Documentos 142. Brasília (DF): Embrapa Hortaliças, 2014. Disponível em: https://www.infoteca.cnptia.embrapa.br/infoteca/handle/doc/1009227
5. Ferreira FP, Caldart ET, Freire RL, Mitsuka-Breganó R, Freitas FM, Miura AC et al. The effect of water source and soil supplementation on parasite contamination in organic vegetable gardens. Braz J Vet Parasitol. 2018;27(3):327-37. https://doi.org/10.1590/S1984-296120180050
6. Food and Agriculture Organization of the United Nations – FAO. World Health Organization. Multicriteria-based ranking for risk management of food-borne parasites. Microbiological Risk Assessment Series (MRA) Nº 23. Rome, 2014. Disponível em: https://apps.who.int/iris/bitstream/handle/10665/112672/9789241564700_eng.df;sequence=1
7. Marouelli WA, Maldonade IR, Braga MB, Silva HR. Qualidade e segurança sanitária da água para fins de irrigação. Comunicado Técnico 134. Brasília (DF): Embrapa; 2014. Disponível em: https://www.infoteca.cnptia.embrapa.br/infoteca/handle/doc/1007665
8. World Health Organization – WHO. Soil-transmitted helminth infections. [acesso 2020 Abril 10]. Disponível em: https://www.who.int/news-room/fact-sheets/detail/soil-transmitted-helminth-infections
9. Novacki JF, Barcelos IB, Valiatti TB, Góis RV. Análise parasitológica de alfaces (Lactuca sativa) comercializadas em um feirão do município de Ji-Paraná, Rondônia. Rev Uningá Review. 2017;29(1):64-9. Disponível em: https://revista.uninga.br/uningareviews/article/view/1934/1530
10. Oliveira GAD, Mesquita NB, Amaral FR, Pereira M, Soto FRM. Pesquisa de ovos e larvas de helmintos intestinais, cistos de protozoários e bactérias do grupo coliforme em alfaces comercializadas em uma feira livre do município de São Roque – SP. Sci Vitae. 2018;6(22):10-5. Disponível em: https://revistaifspsr.com/v6n22.pdf#page=10
11. Mattos EC, Santana JP, Sgarbosa NO, Dal Col R, Daros VMDSG, Prado SPT. Qualidade microscópica de alfaces (Lactuca sativa L.) oriundas de diferentes formas de cultivo e minimamente processadas comercializadas em municípios das regiões nordeste e metropolitana do estado de São Paulo. Vigil Sanit Debate. 2021;9(3):149-58. https://doi.org/10.22239/2317-269X.01757
12. Adenusi AA, Abimbola WA, Adewoga TO. Human intestinal helminth contamination in prewashed, fresh vegetables for sale in major markets in Ogun State, southwest Nigeria. Food Control. 2015;50:843-9. https://doi.org/10.1016/j.foodcont.2014.10.033
13. Balarak D, Ebrahimi M, Modrek MJ, Bazrafshan E, Mahvi AH, Mahdavi Y. Investigation of parasitic contaminations of vegetables sold in markets in the city of Tabriz in 2014. Glob J Health Sci. 2016;8(10):178-84. https://doi.org/10.5539/gjhs.v8n10p178
14. Silva LGB, Silva LMB, Arrais FMA, Melanda GCS, Ferreira RJ. Prevalência de estruturas parasitárias de protozoários e de helmintos em hortaliças comercializadas em barracas de rua no município de Crato – CE, Brasil. Saúde (Sta Maria). 2018;44(3). https://doi.org/10.5902/2236583429982
15. Amer OH, Ras R, El-Alfy SA, Raef A. Prevalence and morphological characters of Strongyloides stercoralis contaminating some fresh raw vegetables in Sharkia province, Egypt. EVMSPJ. 2020;16(1):158-71. https://doi.org/10.21608/evmspj.2020.132894
16. Rodrigues AC, Silva MDC, Pereira RAS, Pinto LC. Prevalence of contamination by intestinal parasites in vegetables (Lactuca sativa L. and Coriandrum sativum L.) sold in markets in Belém, northern Brazil. J Sci Food Agric. 2020;100:2859-65. https://doi.org/10.1002/jsfa.10265
17. Rocha LFN, Rodrigues SS, Santos TB, Pereira MF, Rodrigues J. Detection of enteroparasites in foliar vegetables commercialized in street- and supermarkets in Aparecida de Goiânia, Goiás, Brazil. Braz J Biol. 2022;82:e245368. https://doi.org/10.1590/1519-6984.245368
18. Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D et al. Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet. 2006;367(9521):1521-32. https://doi.org/10.1016/S0140-6736(06)68653-4
19. Amoah ID, Singh G, Stenström TA, Reddy P. Detection and quantification of soil-transmitted helminths in environmental samples: a review of current state-of-the-art and future perspectives. Acta Trop. 2017;169:187-201. https://doi.org/10.1016/j.actatropica.2017.02.014
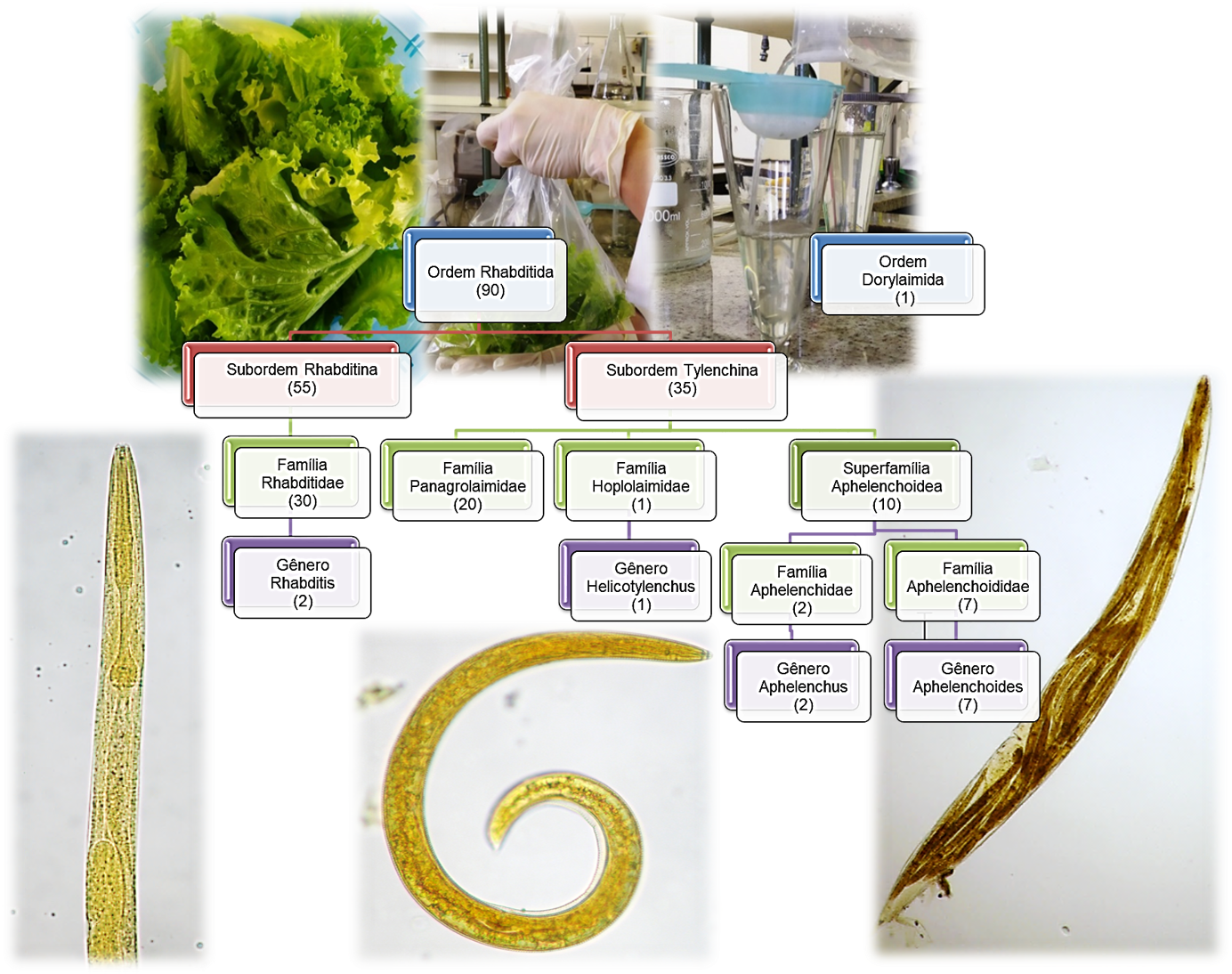
20. Ferraz LCCB, Brown DJF, editores. Nematologia de plantas: fundamentos e importância. Manaus: Norma Editora; 2016. p. 251. [acesso 2020 Jul 27]. Disponível em: https://www.nematologia.com.br/files/livros/1.pdf
21. Yamada LFP. Detecção de nematódeos em alfaces (Lactuca sativa L.) comercializadas em São Paulo: diagnóstico diferencial com padrão de larvas de risco à saúde [dissertação de mestrado]. São Paulo (SP): Secretaria de Estado da Saúde de São Paulo; 2021. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1358837
22. Pauli-Yamada LF, Pinto PLS. Caracterização morfológica e morfométrica de estágios larvares de Strongyloides spp., ancilostomídeos e Angiostrongylus spp.: subsídios para identificação em amostras ambientais. Rev Inst Adolfo Lutz. 2023;82:e39163. https://doi.org/10.53393/rial.2023.v82.39163
23. Matosinhos FC, Valenzuela VC, Silveira JA, Rabelo EM. Standardization of a method for the detection of helminth eggs and larvae in lettuce. Parasitol Res. 2016;115(5):1827-34. https://doi.org/10.1007/s00436-016-4922-8
24. Andrassy I. A taxonomic review of the Suborder Rhabditina (Nematoda: Secernentia). Paris: Editions Orstom; 1983. Disponível em: https://core.ac.uk/download/pdf/39873972.pdf
25. Ferraz LCCB. Chave ilustrada de identificação dos principais gêneros de fitonematoides no Brasil baseada em caracteres das fêmeas. In: Diagnose de Fitonematoides. Campinas: Millennium Editora; 2016. p. 237-53.
26. De Ley P, Blaxter ML. A new system for Nematoda: combining morphological characters with molecular trees, and translating clades into ranks and taxa. Nematology Monographs and Perspectives. 2004;2:633-53. https://doi.org/10.1163/9789004475236_061
27. Ferris H. The Nematode-plant expert information system. A Virtual Encyclopedia on Soil and Plant Nematodes. Department of Entomology and Nematology. University of California, Davis, California. [acesso 2020 Ago 03]. Disponível em: https://nemaplex.ucdavis.edu/
28. Ritzinger CHSP, Fancelli M, Ritzinger R. Nematoides: bioindicadores de sustentabilidade e mudanças edafoclimáticas. Rev Bras Frutic. 2010;32(4):1289-96. https://doi.org/10.1590/S0100-29452010000400045
29. Maistro LC. Alface minimamente processada: uma revisão. Rev Nutr. 2001;14(3):219-24. https://doi.org/10.1590/S1415-52732001000300008
30. Soares B, Cantos GA. Detecção de estruturas parasitárias em hortaliças comercializadas na cidade de Florianópolis, SC, Brasil. Rev Bras Cienc Farm. 2006;42(3):455-60. https://doi.org/10.1590/S1516-93322006000300015
31. Silva AS, Silva IMM, Rebouças LT, Almeida JS, Rocha EVS, Amor ALM. Análise parasitológica e microbiológica de hortaliças comercializadas no município de Santo Antônio de Jesus, Bahia (Brasil). Vigil Sanit Debate. 2016;4(3):77-85. https://doi.org/10.22239/2317-269x.00655
32. Esteves FAM, Figueirôa EDO. Detecção de enteroparasitas em hortaliças comercializadas em feiras livres do município de Caruaru (PE). RBSP. 2009;33(2):184-93. Disponível em: https://rbsp.sesab.ba.gov.br/index.php/rbsp/article/view/204/pdf_19
33. Pacífico BB, Bastos OMP, Uchôa CMA. Contaminação parasitária em alfaces crespas (Lactuca sativa var. crispa), de cultivos tradicional e hidropônico, comercializadas em feiras livres do Rio de Janeiro (RJ). Rev Inst Adolfo Lutz. 2013;72(3):219-25. Disponível em: https://docs.bvsalud.org/biblioref/ses-sp/2013/ses-30122/ses-30122-5467.pdf
34. Caldwell KN, Anderson GL, Williams PL, Beuchat LR. Attraction of a free living nematode, Caenorhabditis elegans, to foodborne pathogenic bacteria and its potential as a vector of Salmonella Poona for preharvest contamination of cantaloupe. J Food Prot. 2003;66(11):1964-71. https://doi.org/10.4315/0362-028X-66.11.1964
35. Kenney SJ, Anderson GL, Williams PL, Millner PD, Beuchat LR. Persistence of Escherichia coli O157: H7, Salmonella Newport, and Salmonella Poona in the gut of a free-living nematode, Caenorhabditis elegans, and transmission to progeny and uninfected nematodes. Int J Food Microbiol. 2005;101(2):227-36. https://doi.org/10.1016/j.ijfoodmicro.2004.11.043
36. Huamanchay O, Genzlinger L, Iglesias M, Ortega YR. Ingestion of Cryptosporidium oocysts by Caenorhabditis elegans. J Parasitol. 2004;90(5):1176-8. https://doi.org/10.1645/GE-253R
37. Neres AC, Nascimento AH, Lemos KRM, Ribeiro EL, Leitão VO, Pacheco JBP et al. Enteroparasitos em amostras de alface (Lactuca sativa var. crispa), no município de Anápolis, Goiás, Brasil. Biosci J. 2011;27(2). Disponível em: https://www.seer.ufu.br/index.php/biosciencejournal/article/view/7613
38. Rocha A, Mendes RA, Barbosa CS. Strongyloides spp. e outros parasitos encontrados em alfaces (Lactuca sativa). Rev Patol Trop. 2008;37(2):151-60. https://doi.org/10.5216/rpt.v37i2.5046
39. Terto WDS, Oliveira RG, Lima MM. Avaliação parasitológica em alfaces (Lactuca sativa L.) comercializadas em Serra Talhada, Pernambuco, Brasil. Vigil Sanit Debate. 2014;2(3):51-7. https://doi.org/10.3395/vd.v2i3.220
40. Cares JE, Huang SP. Taxonomia atual de fitonematóides: chave sistemática simplificada para gêneros – parte I. Revisão Anual de Patologia de Plantas. 2000;8:185-223. Disponível em: https://nematologia.com.br/files/rapp/rapp18.pdf
41. Moravec F, Anderson RC, Chabaud AG, Willmott S. Keys to the nematode parasites of vertebrates. Archival Volume. Wallingford: CAB International; 2009. https://doi.org/10.1186/1756-3305-2-42
42. Little MD. Comparative morphology of six species of Strongyloides (Nematoda) and redefinition of the genus. J Parasitol. 1966;52(1):69-84. https://doi.org/10.2307/3276396
43. Teixeira ATLS. Strongyloides stercoralis: frequência em exames parasitológicos do Hospital de Clínicas da UNICAMP e análise morfométrica das larvas. Rev Soc Bras Med Trop. 1997;30(1):75-6. https://doi.org/10.1590/S0037-86821997000100016
44. Vieira FM, Lima SS, Bessa ECA. Morfologia e biometria de ovos e larvas de Strongyloides sp. Grassi, 1879 (Rhabditoidea: Strongyloididae), parasito gastrointestinal de Hydrochaeris hydrochaeris (Linnaeus, 1766) (Rodentia: Hydrochaeridae), no Município de Juiz de Fora, Minas Gerais. Rev Bras Parasitol Vet. 2006;15(1):7-12. Disponível em: https://www.redalyc.org/pdf/3978/397841457002.pdf
45. Miné JC. Caracterização de cepas de Strongyloides stercoralis (Bavay, 1876) Stiles & Hassal, 1902 (Rhabditida, Strongyloididae) isoladas de pacientes com e sem sintomatologia da região de Araraquara- SP. [tese]. Araraquara: Universidade Estadual Paulista; 2009. Disponível em: https://repositorio.unesp.br/handle/11449/104538

Este trabalho está licenciado sob uma licença Creative Commons Attribution 4.0 International License.
Copyright (c) 2025 Laís Fernanda de Pauli-Yamada, Márcia Dimov Nogueira, Maria Aparecida Moraes Marciano, Pedro Luiz Silva Pinto